Een langer en gezond leven? Het einde van genetische aandoeningen? Gewassen die kunnen overleven in de meest barre omstandigheden? CRISPR-Cas9 brengt dat en meer binnen handbereik. De groep van Stan Brouns (Bionanoscience) doet fundamenteel onderzoek naar de werking van CRISPR-systemen. Hoe ziet hij de aanstaande revolutie?
‘Kijk, dit is een Cascadecomplex’, zegt Stan Brouns, terwijl hij een vreemd uitziende bonk kunststof laat ronddraaien in zijn handen. Het voorwerp lijkt nog het meest op een stuk koraal, met een chaotisch en oneffen oppervlak. In werkelijkheid is het een model van een klomp eiwitten die je kunt vinden in het cytoplasma van bepaalde bacteriën. ‘Hier, dit eiwit is de ruggengraat van het complex’, wijst Brouns. ‘En zie je die blobs? Dat zijn ook eiwitten. Je hebt ze allemaal nodig, anders werkt het systeem niet.’
Moleculaire schaar
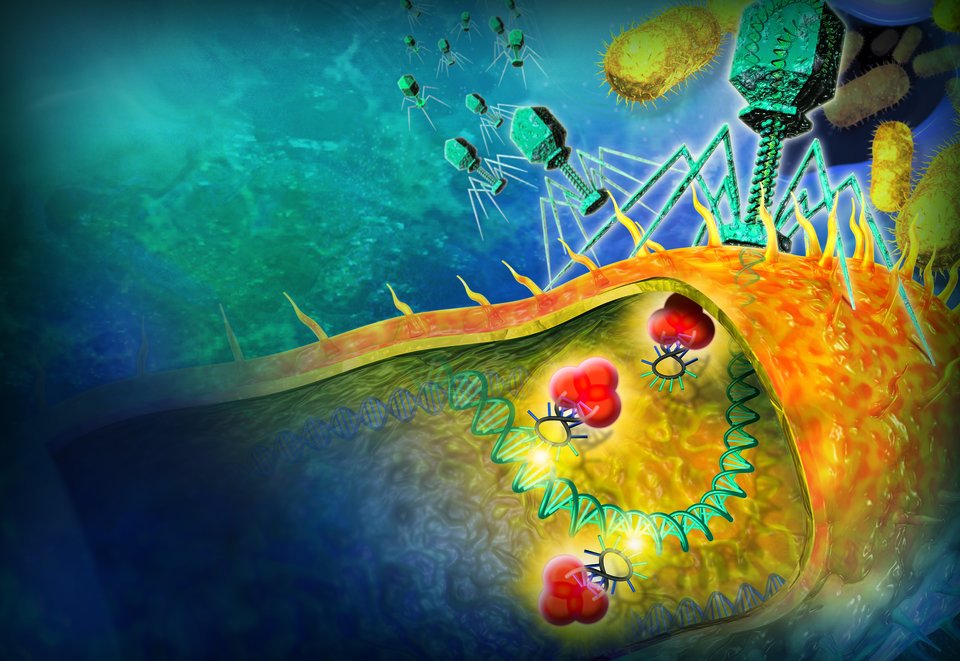
Wat de functie van de eiwittenklomp is? Simpel gezegd is het een wapen om virussen de nek mee om te draaien. En dat is essentieel voor bacteriën, want virussen zijn professionele moordmachines die al sinds het begin van de evolutie de aartsvijand zijn van bacteriën. Elke dag opnieuw doden eenvoudige virussen genaamd bacteriofagen bijvoorbeeld een derde van alle bacteriën in de oceanen. ‘Een virus injecteert zijn DNA of RNA en probeert zo controle over de cel te krijgen’, legt Brouns uit. ‘En als de kaping succesvol is, kan het virus de cel gebruiken als fabriekje om kopieën van zichzelf te maken.’ Het is een even simpele als dodelijke strategie.
Brouns’ eiwittenklomp, het Cascadecomplex, komt in actie zodra een virus zijn erfelijk materiaal injecteert. Het zoekt virus-DNA op, klampt zich eraan vast en geeft dan een seintje aan een ander eiwit. Dat komt erbij en knipt het DNA van het virus met een moleculair schaartje aan stukken. Brouns doet onderzoek naar de werking dit soort bacteriële afweersystemen.
Mysterieuze code
Hoe maakt zo’n Cascadecomplex het onderscheid tussen virus-DNA en het DNA van de bacterie zelf? Dat heeft te maken met iets wat CRISPR wordt genoemd: ‘Clustered Regularly Interspaced Short Palindromic Repeats’. In de jaren 80 van de vorige eeuw ontdekten onderzoekers deze steeds terugkerende codes (‘repeats’) in het DNA van de bekende E. coli-bacterie. ‘Niemand wist toen nog wat de sequenties betekenden’, vertelt Stan Brouns. ‘Pas in 2005 ontdekte men dat het DNA dat tussen de repeats zat overeenkwam met het DNA van virussen.’
Wat bleek? Soms overleeft een bacterie een aanval van een virus, bijvoorbeeld omdat het virus verzwakt is. De bacterie pakt in dat uitzonderlijke geval een stukje DNA van het virus af. Door zijn DNA open te ritsen op de plek van de repeats, bouwt de bacterie dat virale DNA vervolgens in zijn eigen erfelijke code in. Het effect is vergelijkbaar met de werking van een vaccin, want vanaf dat moment heeft de bacterie het virus in zijn ‘geheugen’ gegrift staan. Als hetzelfde type virus zo onverstandig is om later nog eens langs te komen, herkent de bacterie de aanvaller en kan hij er knippende eiwitten zoals het Cascadecomplex op af sturen. Met twee strengen virus-RNA als spiekbriefje gaat de eiwittenklomp op jacht naar vijandig DNA. En als het complex een match vindt, is het een kwestie van grijp, knip, weg.
Knippen en plakken
Maar CRISPR-systemen zoals het Cascadecomplex zijn veel meer dan een biologische curiositeit. Sinds de herfst van 2012 kunnen wetenschappers er DNA mee herschrijven. Jennifer Doudna (UC Berkeley, VS) en Emmanuelle Charpentier (destijds Universiteit van Umeå, Zweden) slaagden er toen namelijk in om het CRISPR-systeem van een streptokok, dat gebruikmaakt van het eiwit Cas9, om te bouwen. De onderzoekers trokken het bacteriële verdedigingsmechanisme uit elkaar, waarna een postdoc van Doudna de twee RNA-strengen combineerde tot één stuk ‘gids-RNA’ (het ‘spiekbriefje’), dat hij naar eigen inzicht kon programmeren. Vanaf dat moment was het mogelijk om elk willekeurig stuk DNA te gebruiken als gids-RNA, en dus om op elke gewenste plek in het DNA te knippen.
Natuurlijk is DNA kapot knippen iets anders dan DNA herschrijven. Maar ook dat laatste bleek bij nader onderzoek mogelijk te zijn met CRISPR-Cas9. Onderzoekers kunnen tegenwoordig een stuk DNA meesturen met het Cas9-eiwit. Zodra het eiwit het DNA in een cel doormidden knipt, zal die cel de streng zo snel mogelijk proberen te repareren. Als de uiteinden van het meegestuurde stukje DNA op de uiteinden van het kapot geknipte DNA passen, zal de cel het meegestuurde erfelijke materiaal gebruiken bij de reparatie. Tussen de uiteinden van het meegestuurde stuk DNA kunnen onderzoekers andere nucleotiden (en zelfs complete genen) zetten.
Agressieve witte bloedcellen
CRISPR-Cas9 wordt inmiddels door duizenden onderzoekers over de hele wereld gebruikt om heel precies genen uit te schakelen of te overschrijven. Het potentieel van de technologie is enorm. ‘Heel concreet loopt er nu bijvoorbeeld een klinische trial waarbij witte bloedcellen van kankerpatiënten agressiever zijn gemaakt met behulp van Cas9’, vertelt Brouns. ‘De hoop is dat de aangepaste witte bloedcellen tumoren hierdoor op eigen kracht kunnen opruimen.’ Het is maar één voorbeeld van de vele mogelijkheden van CRISPR-Cas9.
Toch heeft de technologie ook zo zijn beperkingen. ‘Gene editing in levende wezens is bijvoorbeeld lastig’, aldus Brouns. Zeker als je iets probeert te veranderen in weefsel dat nauwelijks vernieuwd wordt. Neem de ziekte van Duchenne, die spieren aantast en verzwakt. Brouns: ‘Los van de ethische bezwaren zou je die ziekte in theorie kunnen uitschakelen in een embryo. Of kunnen selecteren voor een embryo dat de aandoening niet heeft, zoals nu al in de kliniek gebeurt. Maar als iemand de ziekte heeft, ben je eigenlijk te laat.’ Al komen wetenschappers toch nog een heel eind in de richting van genezing. ‘Het is mogelijk om een reparatie-sequentie in te bouwen in een bepaald virus, en dat virus toe te dienen aan een muis met Duchenne. Het virus zorgt vervolgens voor de verspreiding van het nieuwe genetische materiaal.’ Het gevolg? Muizen met sterkere spieren. Maar helaas nog niet zo sterk als die van gezonde muizen.
Kist vol gereedschap
Wat niet iedereen weet, is dat er veel meer CRISPR-systemen zijn dan alleen de variant die gebruikmaakt van het inmiddels beroemde Cas9-eiwit. En de één werkt net even anders dan de ander. In plaats van een rechte knip maakt een eiwit bijvoorbeeld een gehoekte knip in het DNA, waardoor het reparatiemateriaal er als een puzzelstukje op past en een cel zijn DNA met een grotere slagingskans kan repareren. En ook de grootte van de Cas-eiwitten verschilt per systeem. Cas9 is relatief fors, en kan daarom niet in zomaar elke cel zijn werk doen. Een ander knipenzym, genaamd Cpf1 is bijvoorbeeld ook veelbelovend. ‘Cpf1 gaat het helemaal maken’, voorspelt Brouns. ‘Het heeft één klein RNA’tje dat beide DNA-strengen kan doorknippen. En met maar 40 nucleotiden, in plaats van de 100 van Cas9, is het goedkoper om te maken. Bovendien is het gemakkelijker om ermee op meerdere plekken tegelijkertijd te knippen.’
Kortom, CRISPR-Cas is niet één ding, maar een kist vol met allerlei soorten gereedschap. De ene klus zal om een schroevendraaier vragen, terwijl je voor de andere juist een hamer nodig hebt. En het goede nieuws is dat de gereedschapskist steeds voller wordt. Hopelijk leiden nieuwe vondsten uiteindelijk tot een situatie waarbij wetenschappers alle mogelijke cellen naar hun hand kunnen zetten.
Grenzen overschrijden
Waar zal dit eindigen? De eerste kinderen met aangepast DNA zijn inmiddels geboren. Kunnen we, nu het hek toch van de dam is,ongeboren kinderen ook niet meteen wat intelligenter maken? Met paarse ogen? En misschien van die schattige kuiltjes in de wangen? ‘Tja’, zegt Brouns, ‘Op een gegeven moment overschrijd je de grens van ziekten naar iets wat mensen wenselijk vinden. Daar moeten we goed over nadenken.’
Brouns weet natuurlijk dat dit soort vragen zich steeds nadrukkelijker opdringen. Maar zijn doel is om de biologie achter CRISPR-Cas-systemen te doorgronden. Om tot in het kleinste detail uit te vogelen hoe de bijzondere afweermechanismen werken. Een vraag die de Brouns-groep nu bijvoorbeeld probeert te beantwoorden is waarom bacteriën altijd specifieke stukjes virus-DNA pakken om in te bouwen in hun eigen DNA, en niet andere. Dit soort vragen zullen Brouns en zijn onderzoeksgroep de komende tijd nog wel zoet houden. ‘Al weten we inmiddels best veel, ik verwacht dat er nog veel afweermechanismen te ontdekken zijn in micro-organismen.’
Wat steeds weer opvalt, is hoe vernuftig de CRISPR-systemen zijn. En dat is ook precies hun aantrekkingskracht. ‘Het blijkt allemaal toch elke keer complexer te werken dan we in eerste instantie hadden verwacht’, zegt Brouns. ‘We blijven ons erover verbazen.’