De geheimen van het leven ontrafelen met superresolutie-microscopie
Werd de basis voor de microscopie meer dan drie eeuwen geleden gelegd door mensen als Antonie van Leeuwenhoek, het vakgebied heeft zich de afgelopen tien jaar razendsnel ontwikkeld. Dr. ir. Carlas Smith werkt nu aan een nieuwe doorbraak: een microscoop die verschillende technieken combineert om zo te onthullen wat er echt in levend weefsel gebeurt.
De Delftenaar Antoni van Leeuwenhoek is de grondlegger van het vakgebied van Carlas Smith, de microscopie. Het is dan ook begrijpelijk dat Smith nog steeds de invloed van Van Leeuwenhoek voelt. “Hoewel ik als onderzoeker in Boston en Oxford ben geweest, ben ik als academicus toch geworteld in Delft. Toen ik in Delft natuurkunde studeerde, werd ik al aangetrokken door life science and technology. Dit bracht me in aanraking met het werk van Van Leeuwenhoek.”
“Er is nog een connectie met Van Leeuwenhoek, namelijk via een uitspraak van de Duitse wetenschapper Stefan Hell, een Nobelprijswinnaar uit mijn vakgebied. Hij beweerde dat lenzenmakers tot en met de negentiende eeuw de 'koningen' van ons vakgebied waren. Met de beste lenzen bereikte je de hoogste resolutie. Van Leeuwenhoek was in de eerste plaats zo'n lenzenmaker. Hell voegde eraan toe dat dit in de huidige microscopie niet langer het geval is. Het is nu een samenspel waarbij opto-mechatronica op een slimme manier wordt gecombineerd met algoritmes.”
“Galileo is een andere inspiratiebron. Zijn motto, ‘meet wat meetbaar is en maak meetbaar wat niet meetbaar is’, spreekt me aan. Mijn fascinatie ligt in het waarnemen van dingen die nog nooit eerder zijn waargenomen, vooral in de biologie. Tijdens mijn promotieonderzoek in de Verenigde Staten zagen we bijvoorbeeld voor het eerst hoe een mRNA-molecuul zich verplaatst vanuit de celkern naar de rest van de cel, een cruciaal biologisch proces. Dat was buitengewoon spannend.”

Carlas Smith
Superresolutiemicroscopie
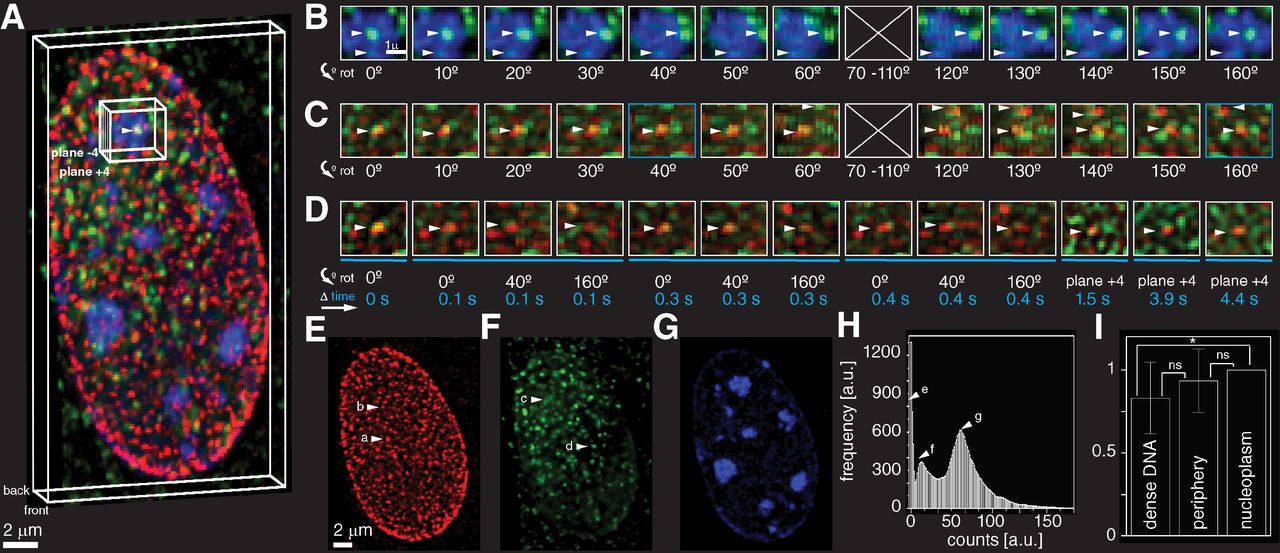
Superresolutiemicroscopie is het vakgebied waar Carlas Smith zich mee bezighoudt, met name voor het onderzoek van biologische weefsels. "In de natuurkunde zijn er technologieën zoals de elektronenmicroscoop, die een veel hogere resolutie bieden dan de huidige superresolutiemicroscopie. Dus waarom hebben we dan nog iets anders nodig? Het verschil is dat superresolutiemicroscopie veel groter contrast en specificiteit biedt, namelijk door het gebruik van fluorescentie. Het is alsof je een lichtbaken aan de moleculen koppelt die je wilt bestuderen en de rest is donker. Naast hoger contrast en hogere specificiteit is de mogelijkheid om levende organismen te bestuderen de reden waarom biologen deze techniek zo waardevol vinden."
“Superresolutiemicroscopie stelt ons in staat om het binnenste van cellen te observeren. De techniek maakt gebruik van lichtgevende eiwitten die oorspronkelijk in kwallen voorkwamen. Onderzoekers kunnen deze fluorescerende eiwitten via genbewerking aan moleculen hechten. Wanneer ze deze eiwitten met een laser belichten, zenden ze kort daarna licht uit. Gevoelige sensoren registreren deze lichtsignalen en onderzoekers kunnen met behulp van algoritmes waardevolle informatie uit de ruis halen om afbeeldingen te construeren. Terwijl een gewone optische microscoop afbeeldingen op een schaal van ongeveer een kwart micron kan maken, kan superresolutiemicroscopie dit bijna honderd keer zo nauwkeurig doen.”
Mijn fascinatie ligt in het waarnemen van dingen die nog nooit eerder zijn waargenomen, vooral in de biologie.
“Het veld van superresolutiemicroscopie heeft zich het afgelopen decennium razendsnel ontwikkeld. In 1995 werd al een abstracte paper gepubliceerd die stelde dat als het mogelijk is om moleculen in een cel van elkaar te onderscheiden, ze ook individueel bekeken, gelokaliseerd en gevolgd kunnen worden. De grote doorbraak kwam in 2006. In de aanloop naar deze cruciale publicatie werden fluorescente moleculen ontdekt die onder bepaalde omstandigheden knipperden. Als alles donker was en slechts één molecuul 'aan' ging, kon dit worden onderscheiden. Men begreep meteen dat deze moleculen veelbelovende mogelijkheden boden. Dit leiden tot de nobel prijs in 2014.”
“Daarna ontwikkelde superresolutiemicroscopie zich snel, bijvoorbeeld door uitbreiding van 2D naar 3D. In 2017 werd een andere belangrijke stap gezet. Door slim gebruik te maken van de structuur van de belichting kon de resolutie verder worden verbeterd. In 2019 hebben we in Delft aanzienlijke verbeteringen gerealiseerd. Door horizontale en verticale lichtpatronen afwisselend over het monster te leggen en te verschuiven, kunnen de locaties van moleculen zeer nauwkeurig worden bepaald. Door deze Delftse superresolutie innovatie werd de resolutie dubbel zo hoog.”
Correctie op Nobelprijswinnaar
Vorig jaar volgde een nieuwe opmerkelijke wetenschappelijke bijdrage van de onderzoeksgroep van Smith. Er werd namelijk namelijk een belangrijke wetenschappelijke correctie gepubliceerd, en nog wel op het werk van de eerdergenoemde Nobelprijswinnaar Stefan Hell. Onderzoekers van het lab van Hell stelden in 2020 dat door hun Iterative Single-Molecule Localization Microscopy de resolutie veel verder zou verbeteren. De TU Delft-onderzoekers lieten echter wiskundig zien dat deze grote resolutieverbeteringen in de praktijk vrijwel onhaalbaar zijn. In praktische omstandigheden kun je op zijn hoogst een verbetering van ongeveer vijf keer krijgen ten opzichte van de standaardtechniek. Het veld ging er grotendeels vanuit dat het potentieel veel groter was. De Delftenaren toonden echter via een andere wiskundige aanpak aan dat de resolutieverbeteringen van de groep van Hell in de praktijk lastig te bereiken zijn.
De toekomst van de microscopie
“Het veld bevindt zich nu op een soort tweesprong. Het mysterie van het leven is immers diep in de cel verstopt, kleiner dan een miljoenste meter, én gebeurt razendsnel, in minder dan een tiende seconde. De ene microscoop kan inzoomen op de kleinste details, de andere maakt snelle foto’s, maar er is nog geen techniek die het allebei kan. Dus óf je kunt een hele hoge resolutie in de ruimte halen, óf je kunt een hoge tijdresolutie halen. En dat laatste heb je zeker ook nodig om allerlei snelle biologische processen beter te kunnen volgen in de tijd. Je wilt die twee combineren. Wij zijn denk ik vrij uniek, in de zin dat we hier heel veel oog voor hebben.”
“Om hier stappen in te zetten, heb ik een Vidi-voorstel ingediend, dat in 2023 werd toegewezen. Dit betekent erkenning van ons onderzoek en verdere opschaling. We ontwikkelen nu een microscoop opgebouwd uit meerdere microscopietechnieken en bouwen een algoritme om de gemaakte foto’s slim met elkaar te combineren. We combineren parallelle data en ‘fuseren’ deze. Je hebt één meting met een bepaalde onzekerheid en een andere met een bepaalde onzekerheid. Als je die twee samenvoegt, krijgt je een kleinere onzekerheid.
Dat inzicht is op zich niet nieuw, maar om het te realiseren, krijg je te maken met allerlei verschillende technische uitdagingen. Je moet bijvoorbeeld een nieuw instrument bouwen dat verschillende technieken kan hanteren, cellen maken die hiervoor geschikt zijn en een algoritme dat dit allemaal aankan.”
Wij maken met deze nieuwe microscoop eigenlijk de hamer en de schroevendraaier van de toekomst.
“Een hele set aan engineering challenges dus. Je moet aan álle aspecten werken. De combinatie van optica, nanobiologie, mechatronica en algoritmes is essentieel. Delft is traditioneel sterk in de optica en nanobiologie maar hier in het Centre for Systems and Control – onderdeel van de faculteit ME – zijn we heel goed in signaalverwerking en mechatronica. We hebben hier in Delft dus een hele strategische positie, die je echt niet zomaar bij elkaar hebt, maar die wel nodig is om de volgende stappen te realiseren. Traditioneel werden hier, bij wijze van spreken, de hamer en de schroevendraaier gehanteerd. Wij maken met deze nieuwe microscoop eigenlijk de hamer en de schroevendraaier van de toekomst.”