Fagenbank zoekt alternatief voor antibiotica
Bacteriële infecties blijken steeds vaker ongevoelig voor antibiotica. Kunnen bacteriofagen een alternatief bieden? De Fagenbank brengt de effectiviteit in kaart.
Jaarlijks overlijden in Europa 33 duizend mensen aan infecties met resistente bacteriën en de verwachting is dat dit er in 2050 wereldwijd 10 miljoen zullen zijn. Alternatieve bestrijdingsmethoden zijn dus meer dan welkom, maar hoe effectief zijn bacteriofagen? En wat zijn de bijwerkingen?
Wat zijn bacteriofagen?
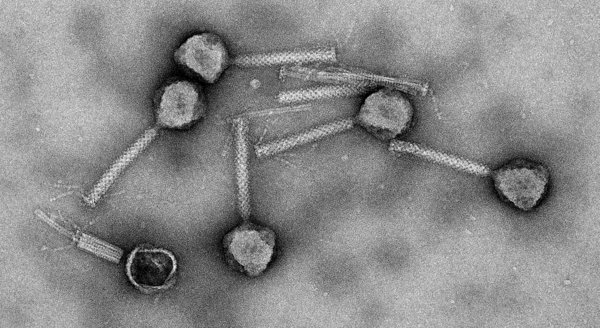
Bacteriofagen zijn virussen die bacteriën kunnen aanvallen en doden. Verplaats je even in de microwereld. Om je heen zweven bacteriën, die in werkelijkheid tussen 1 en 5 micrometer groot zijn. Daar tussendoor zwemmen bazooka-vormige structuren, op de tast op zoek naar een prooi. Dit zijn bacteriofagen, al sinds miljarden jaren het natuurlijke gezelschap van bacteriën. Ze zijn samen geëvolueerd en hebben generatie na generatie elkaars afweer weten te overtroeven.
Wanneer een bacteriofaag een geschikte gastheer herkent, koppelt hij de loop van de bazooka aan het membraan van de bacterie. Dat activeert een mechanisme dat de inhoud uit de kop met kracht in de bacterie spuit. Een faag is qua omvang een tiende van zijn prooi, maar uitmuntend toegerust op zijn enige taak in het bestaan: een bacterie zoveel mogelijk kopieën van zichzelf te laten produceren.
“Het zijn de ultieme nanomachientjes”, zegt microbioloog dr. Stan Brouns (Technische Natuurwetenschappen). “Ze zijn vele malen ingewikkelder dan wat wij momenteel kunnen ontwerpen.”
En toch zijn deze complexe machientjes van zeer bescheiden komaf. De rijkste bronnen van bacteriofagen zijn doucheputjes, darmkanalen, rioolwater van een ziekenhuis of afvalwaterzuivering. Ook de diepgevroren collectie van de fagenbank vindt daar zijn oorsprong.
Ruim honderd jaar geleden werd de bacteriedodende werking van bepaalde stoffen ontdekt door de Engelse bacterioloog Frederick Twort en de Frans-Canadees Félix d’Hérelle. ‘’Begin 1919 isoleerde d’Hérelle bacterio-
fagen uit het filtraat van kippenstront en wist daarmee kippentyfus te bestrijden. Dat gaf hem zoveel vertrouwen in de aanpak dat hij in augustus van datzelfde jaar een dysenteriepatiënt op soortgelijke wijze behandelde, met succes. Daarna volgden vele anderen.
Hoewel niemand wist wat een bacteriofaag (letterlijk: iets dat bacteriën eet) feitelijk was, zat d’Hérelle er niet ver naast met zijn omschrijving van ‘een biologisch organisme dat teert op bacteriën’. Hij zou zijn ogen uitkijken bij de elektronenmicroscoopfoto’s die de bacteriofagen laten zien als nanomachientjes op zoek naar een prooi.
D’Hérelle werd bekend onder artsen in Europa. Hij ontving in 1924 een eredoctoraat van de Universiteit Leiden en een Van Leeuwenhoek-medaille van de Koninklijke Nederlandse Akademie van Wetenschappen. Maar ondanks alle eerbetoon speelden bacteriofagen na de Tweede Wereldoorlog en de introductie van antibiotica geen rol meer in infectiebestrijdingen, althans niet in het Westen.
Weer in de belangstelling
Aan de andere kant van het voormalige IJzeren Gordijn, in Polen en Georgië, werd volop doorgewerkt aan de ontwikkeling van bacteriofagen voor geneeskundige toepassingen. Het fagentherapiecentrum in Tbilisi, dat d’Hérelle zelf nog bezocht, is nu een Amerikaans bedrijf.
Momenteel winnen de bacteriofagen weer aan belangstelling, mede dankzij televisie-uitzendingen in de afgelopen twee jaar. West-Europese patiënten reizen naar Tbilisi en betalen daar duizenden euro’s voor een poliklinische behandeling.
Medici zijn niet blij met de kritiekloze berichtgeving over fagentherapie. Zo reageert medisch microbioloog prof.dr. Marc Bonten (UMC Utrecht) sarcastisch. “Ik heb nog nooit zoveel onzin in zo’n korte tijd gehoord.” In zijn weblog op Reflections on Infection Prevention and Control adviseert hij huisartsen wier patiënten een behandeling met bacteriofagen eisen hen te verwijzen naar hun darmflora.
Kijken wat werkt
“Wij onderzoeken met open vizier of we infecties kunnen bestrijden met fagen”, zegt Brouns over de Fagenbank. “We willen vaststellen wanneer het wel of niet werkt en wat de risico’s zijn. We leggen in de Fagenbank een verzameling van bacteriofagen aan tegen ongeveer 15 soorten bacteriën.” Dat betekent: fagen opkweken in een bacteriekolonie en de fagen eruit filteren. De fagen worden na zuivering bewaard in kleine plastic buisjes in de vriezer, keurig voorzien van een unieke code.
De werkzaamheid van fagen tegen bacteriën wordt met een uitgebreid kruisschema vastgesteld, en vastgelegd in matrices. Groen als faag A bacterie B doodt, geel als er alleen een remming van de bacteriegroei optreedt of wit als de faag geen effect heeft. Zo wordt systematisch kennis opgebouwd over welke faag effectief is tegen welke bacterie.
De ambachtelijke oorsprong van de fagentherapie is vervangen door genetische analyses, systematische screenings en databases. Microbiologie is een exacte wetenschap geworden.
Klinische test
Naast dit fundamentele werk heeft de Fagenbank contact met het UMC Utrecht voor een klinische proef. Hoogleraar medische microbiologie Marc Bonten en arts-microbioloog dr. Pieter-Jan Haas hebben een protocol opgesteld om de werking van bacteriofagen te testen bij een dozijn patiënten met taaislijmziekte met bacteriële infecties in de longen. Die nemen daar twee maal daags medicatie voor in met een puffer. Het voorstel is om daar gerandomiseerd bacteriofagen aan toe te voegen.
“De patiënten zijn hun eigen controlegroep,” legt Bonten uit, “doordat ze afwisselend wel en niet met fagen behandeld worden.” Zo moet duidelijk worden of de fagen infectiebestrijding versterken, of dat toevoeging van bacteriofagen geen of zelfs een negatief effect heeft. Let wel: de fagen worden getest op hun werking als toevoeging aan antibiotica, niet als alternatief. “Het is onethisch om patiënten hun medicatie te onthouden en te vervangen door iets waarvan je niet weet of het werkt”, verklaart Bonten.
Maar zover is het nog niet. Het protocol verkeert al twee jaar in een impasse. Er is een Catch-22-situatie ontstaan omdat de European Medical Authority bacteriofagen als geneesmiddel aanmerkt, zodat de productie ervan moet voldoen aan strenge richtlijnen (good manufacturing practice) die onder meer een steriele productieomgeving vereisen. Alleen: zonder bacteriën kun je geen fagen kweken. Zo is er een situatie ontstaan dat het ministerie van Volksgezondheid, patiënten, apothekers en inspectie allemaal zitten te wachten op een gedegen klinische test, maar dat iedereen gevangen zit in voorschriften en niemand toestemming kan geven voor een test.
Mogelijk biedt de Helsinki Declaration een uitweg. Die staat experimentele behandeling van patiënten toe als er geen reguliere behandeling meer voorhanden is. Maar alleen doodzieke patiënten toelaten tot de klinische test staat haaks op het protocol. Belgen en Fransen zijn minder streng in de leer, dus misschien biedt internationale samenwerking een sluipweg. Bonten en Haas voerenregelmatig overleg met betrokken instanties om een uitgang te vinden uit het labyrint van regels.
Commercieel niet aantrekkelijk
Stel: de klinische proef gaat door, de uitslag laat een positief effect van de fagen zien. Dan is de productie het volgende obstakel. Een bacteriofaag is niet te patenteren, en dus is het voor een farmaceutisch bedrijf commercieel niet aantrekkelijk om erin te investeren. De productie is volgens Haas niet ingewikkeld of duur. Kleinschalige (‘magistrale’) bereiding door de ziekenhuisapotheek lijkt de meest aangewezen weg. Dus zelfs als alles meezit voor de fagen zal de toepassing hoogstwaarschijnlijk kleinschalig zijn. “Dit wordt geen blockbuster”, vat
Bonten samen.
En toch kan het. Op de valreep stuurt Brouns een artikel door uit Nature Medicine (mei 2019). Een Amerikaans-Brits team heeft een 15-jarig meisje met taaislijmziekte genezen van een longontsteking na een transplantatie. Ze deden dat door een intraveneuze behandeling met genetisch aangepaste bacteriofagen. Is dit een blik in de toekomst? <<
De Delftse Fagenbank is een initiatief van microbioloog dr. Stan Brouns. Hier worden bacteriofagen onderzocht als alternatief voor antibiotica. Op 16 april vond de officiële opening plaats tijdens de Medical Delta Conference, een jaarlijkse conferentie over medische technologie. De Fagenbank is voor zijn ondersteuning afhankelijk van donaties. Dankzij een startsubsidie van 144 duizend euro van het Universiteitsfonds Delft kan Brouns voor 2,5 jaar een analist in dienst nemen en laboratoriumkosten betalen. Voor verder onderzoek is Brouns op zoek naar aanvullende financiering.