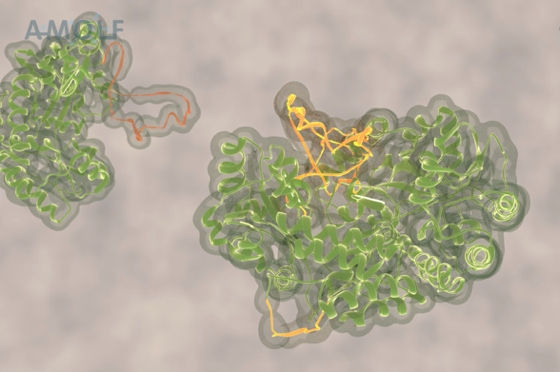
Moleculaire machine trekt toxische eiwitaggregaten uit elkaar
Hoe halen cellen aan elkaar geklonterde eiwitten uit elkaar? Onderzoekers van AMOLF en de universiteit van Heidelberg laten zien dat de moleculaire chaperonne ClpB aan enkele eiwitketens trekt, en deze zo uit de klont haalt. Ze publiceren hun resultaten vandaag in Nature.
Eiwitten zijn lange aminozuurketens die zich in het lichaam opvouwen. Als ze goed gevouwen zijn kunnen ze hun belangrijke functies uitoefenen. Maar als er wat mis gaat klonteren ze samen tot een aggregaat: een kluwen van eiwitten als een in de war geraakte bol touw, die schade kan aanrichten. Eiwitaggregatie wordt in verband gebracht met de ziekte van Alzheimer en andere medische aandoeningen.
ClpB trekt lussen in eiwitketens
Film die dit onderzoek illustreert:
Moleculaire opruim machines
Organismen hebben een opruimdienst voor deze eiwitkluwens: een groep eiwitten die chaperonnes worden genoemd. Het was bekend dat de Hsp100-familie van chaperonnes, waar ClpB (spreek uit: club B) lid van is, aggregaten weer kunnen oplossen. Maar hoe zij dit doen was nog nooit direct gemeten.
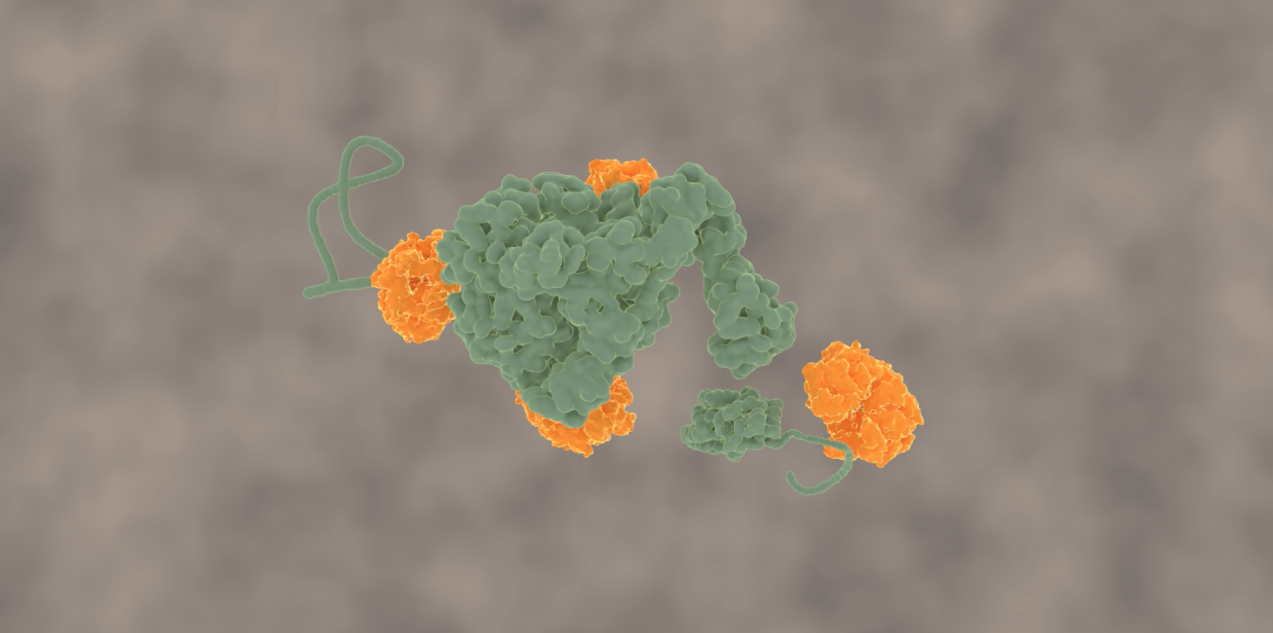
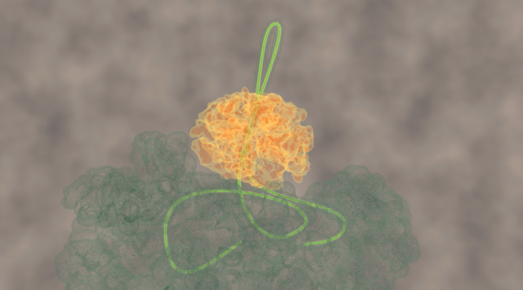
Onderzoekers Mario Avellaneda en Sander Tans van het Amsterdamse AMOLF en Bernd Bukau en Axel Mogk van de universiteit van Heidelberglaten nu voor het eerst zien hoe deze chaperonnes de eiwitketen ontwarren. Tans legt uit: “De ringvormige ClpB blijkt de eiwitketen als een lus door zijn centrale kanaal heen te trekken. Omdat de kluwen niet door de ring past, wordt de eiwitketen steeds verder uit de kluwen getrokken en kan daarna weer normaal opvouwen.”
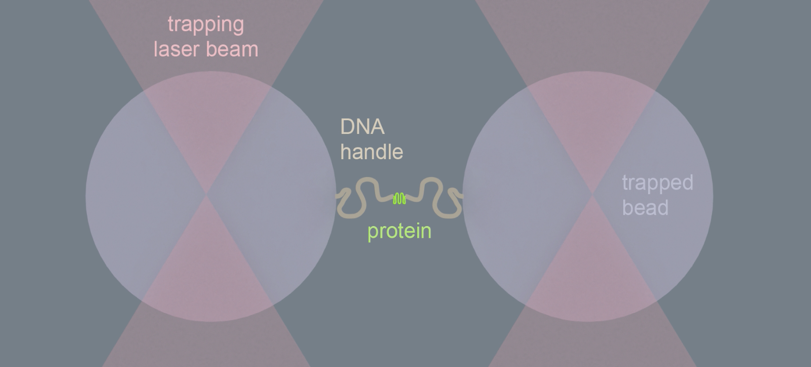
Trekken met licht
De onderzoekers grepen daarvoor een eiwit bij de uiteinden vast met twee optische pincetten, die het eiwit vasthouden met laserlicht. Met dit pincet konden ze de afstand tussen de twee uiteinden van het eiwit heel precies meten, en daaruit opmaken of de keten gestrekt of gevouwen is. Na het toevoegen van de chaperonne ClpB aan een gestrekte keten, zagen de onderzoekers dat de afstand tussen de twee uiteinden van de eiwitketen steeds kleiner werd – zonder de laserbundels te verplaatsen. Deze observatie verraste de onderzoekers. Ze concludeerden daaruit dat ClpB de keten als lus door zijn kanaal transporteerde, en de uiteinden van de eiwitketen naar elkaar toegebracht.
ClpB afbeelden
Omdat deze vorming van lussen in eiwitketens nog nooit eerder was gezien, zochten de onderzoekers naar extra bewijs. Ze hingen een fluorescent molecuul aan ClpB en konden zo volgen hoe ClpB over de eiwitketen beweegt. Deze bewegingen zijn erg klein zijn, maar bleken wel meetbaar. De experimenten lieten zien dat ClpB eerst bindt op een min of meer willekeurige plek op de uitgestrekte eiwitketen. Daarna trekt het het ene uiteinde van de keten naar zich toe, of het andere, of beide tegelijk. Beide armen van de lus kunnen dus tegelijkertijd door de ring heen getrokken worden.
Tans: “We weten hoe lastig het kan zijn om een dubbelgevouwen draad in het oog van een naald te krijgen. ClpB krijgt dit voor elkaar door een aantal minuscule palletjes die binnenin het kanaal zitten. ClpB kan deze palletjes op en neer bewegen als kleine vingertjes, gebruik makend van de ATP-brandstof moleculen die de cel ook maakt. Op deze manier kan een aminozuur keten erdoorheen geduwd worden. Hoe die palletjes precies werken is nog een vraag. We konden wel zien dat ze in salvo’s werken: eerst bewegen meerdere palletjes achter elkaar, dan pauzeren ze, en daarna bewegen ze weer, enzovoort. Waarschijnlijk is die pauze nodig om nieuwe ATP-moleculen te laten binden.”
Snel en efficiënt
De resultaten brengen ook duidelijkheid, want er was veel speculatie, zegt Tans: “Een van de ideeën was dat vele ClpB’s op willekeurig plakkerige delen van het aggregaat binden, een beetje zoals zeepmoleculen vet losweken. Ander studies suggereerden dat maximaal één segment van een eiwitketen in het ClpB kanaal zou passen, en een lus zou niet passen. Wij hebben nu aangetoond dat ClpB fysiek aan het aggregaat trekt. De chaperonne werkt als een motor dat het eiwit ontrafelt door aan lussen te trekken. Het blijft trekken totdat de eiwitketen helemaal uit de kluwen getrokken is.”
Belangrijk voor mensen
De volgende stap die Tans en collega's nu maken is het onderzoeken van menselijke chaperonnes en eiwitten. Het is verleidelijk om te denken dat dit onderzoek direct naar een geneesmiddel voor Alzheimer leidt. “In principe kan je daar nu aan denken. Maar in de praktijk is dat nog niet zo eenvoudig,” zegt Tans. “Zomaar eiwitten aan het lichaam toevoegen kan ook schade aanrichten. Het onderzoek geeft aan dat we nu moeten kijken naar de regulatie van dit trekproces.”
Het onderzoek is niet alleen van belang voor het oplossen van eiwitaggregaten. Het feit dat ClpB lussen kan trekken uit een eiwitkluwen suggereert dat andere eiwitten in andere cellulaire processen dat ook kunnen, zegt Tans. “Bijvoorbeeld de cel is continu bezig om beschadigde eiwitten af te breken om weer nieuwe te maken – zeg maar de circulaire economie van de cel. Met onze methode kan dit nu onderzocht worden.”
Meer informatie
Mario J. Avellaneda, Kamila B. Franke, Vanda Sunderlikova, Bernd Bukau, Axel Mogk, Sander J. Tans, Processive extrusion of polypeptide loops by a Hsp100 disaggregase, Nature 2020.
DOI: 10.1038/s41586-020-1964-y

Prof. S. J. Tans
AMOLF institute Amsterdam
Delft University of Technology