Kunstmatige celdeling stap dichterbij
Onderzoekers van de TU Delft zijn erin geslaagd om een biologisch mechanisme dat essentieel is voor de celdeling in bacteriën na te bouwen in het lab. Het onderzoek is een belangrijke stap binnen een groter, ambitieus project met als uiteindelijke doel: een volledig door de mens gebouwde cel die zichzelf in stand kan houden en zich kan delen. De onderzoekers hebben hun bevindingen gepubliceerd in Nature Communications.
Celdeling is een complex proces, zelfs in relatief eenvoudige organismen zoals bacteriën. Eerst moet het DNA in de bacteriële cel worden gekopieerd. Vervolgens brengen eiwitten, de ‘werkpaarden’ van de cel, kopieën van het DNA naar de twee polen van de cel. Daarna vormt zich in het midden van de cel een ring, die bestaat uit gespecialiseerde eiwitten. Deze zogeheten ‘Z-ring’ knijpt op het moment dat de cel klaar is om zich te delen samen, waardoor twee dochtercellen ontstaan.
Tikkertje
De eiwitten die de Z-ring vormen, doen dat altijd netjes in het midden van de cel. Maar hoe weten ze waar het midden is? Hiervoor gebruikt de cel weer andere eiwitten, drie stuks in totaal. Het gaat om MinC, MinD en MinE, die samen bekendstaan als het ‘Min-systeem’. Het eiwit MinD hecht zich graag aan het celmembraan. De functie van het eiwit MinE is om MinD van zijn plek te jagen. En de MinC-eiwitten? Die liften mee met de MinD-eiwitten.
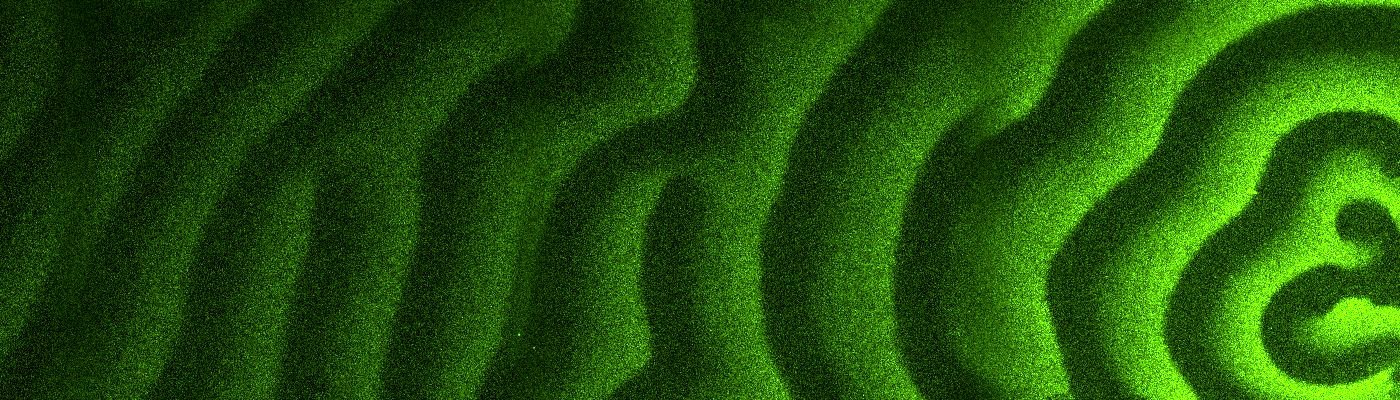
Het samenspel tussen deze drie eiwitten kan worden omschreven als een soort tikkertje, waarbij MinE-eiwitten de aan elkaar gekoppelde MinD- en MinC-eiwitten van de ene naar de andere pool drijven. De MinD-eiwitten zoeken daarbij steeds verderop in de cel een plekje om zich aan het celmembraam vast te klampen, om vervolgens weer van hun plek gejaagd te worden. Dit proces zorgt voor een soort ‘eiwitgolven’ (zie plaatje) die zich van de ene naar de andere pool bewegen.
Door de eiwitgolven (oscillaties) ontstaat in de cel een gradiënt: in de polen is de hoogste concentratie Min-eiwitten te vinden, terwijl in het centrum de concentratie het laagst is. De belangrijkste eigenschap van de meeliftende MinC-eiwitten is dat ze de vorming van de Z-ring onderdrukken. Doordat in het midden van de cel minder van dit eiwit aanwezig is, kan de ring zich daar vrijelijk vormen.
Synthetische cel
Onderzoekers van de TU Delft proberen samen met collega’s uit binnen- en buitenland een ‘synthetische cel’ te bouwen. Het idee is om eerst alle modules die nodig zijn voor een minimale cel te reconstrueren, en ze daarna samen te brengen tot een functioneel geheel. De celdeling is zo’n module, maar bestaat op zijn beurt uit verschillende, met elkaar samenwerkende mechanismen, zoals dus het Min-systeem.
De groep van Christophe Danelon, onderzoeker van de TU Delft, is erin geslaagd om het Min-systeem na te bouwen in kunstmatig gecreëerd vetblaasjes, zogeheten ‘liposomen’. In totaal zijn drie genen voor dit systeem verantwoordelijk, één gen per eiwit. “Maar het is niet genoeg om het DNA van deze drie genen in een liposoom te stoppen”, legt hoofdonderzoeker Elisa Godino uit. Ze vergelijkt het creëren van de juiste omgeving met een recept. “Je moet van elk eiwit een bepaalde hoeveelheid hebben, en de eiwitten functioneren alleen onder de juiste omstandigheden. In het finetunen van die omstandigheden is veel tijd en onderzoek gaan zitten.”
Uiteindelijk is het dus gelukt om het Min-systeem aan de praat te krijgen in een vetblaasje, en zag Elisa Godino door haar microscoop de karakteristieke ‘eiwitgolven’. De volgende stap is het nabouwen van het mechanisme dat verantwoordelijk is voor de constructie van de eerdergenoemde Z-ring, die de cel in tweeën knipt. "We hebben al bevestigd dat het door ons gebouwde Min-systeem goed samenwerkt met de kernelementen van de Z-ring", zegt Godino.
In de nabije toekomst willen de wetenschappers de twee celdelingsmechanismen aan elkaar koppelen, en dat zal ook weer allerlei uitdagingen met zich meebrengen. Maar toch: stapje voor stapje komt de synthetische cel dichterbij.
****
Elisa Godino, Jonás Noguera López, David Foschepoth, Céline Cleij, Anne Doerr, Clara Ferrer Castellà, Christophe Danelon, “De novo synthesized Min proteins drive oscillatory liposome deformation and regulate FtsA-FtsZ cytoskeletal patterns”, Nature Communications (2019)
DOI: 10.1038/s41467-019-12932-w
Elisa Godino
E.Godino@tudelft.nl
015-2782984