CRISPR-Cas9 heeft gene editing een stuk eenvoudiger gemaakt, en gaat er op termijn voor zorgen dat we erfelijke ziekten uit ons DNA kunnen schrijven. Maar ondanks het feit dat we CRISPR-Cas9 en soortgelijke bacteriële immuunsystemen gebruiken als moleculair gereedschap, weten we nog steeds niet altijd hoe ze werken. Een openstaande vraag over het ‘knipeiwit’ Cas3 was tot nu toe bijvoorbeeld: op welke manier knipt het erfelijk materiaal? Trekt het DNA naar zich toe, of klampt het zich aan een streng vast en wandelt het daar vervolgens al knippend overheen? Onderzoekers van de TU Delft hebben nu het antwoord gevonden: Cas3 trekt DNA naar zich toe als een visser die zijn lijn binnenhaalt.
CRISPR-Cas9 staat wereldwijd in de belangstelling als gene editing-technologie. Maar wat niet iedereen weet, is dat er veel meer CRISPR-systemen zijn dan alleen de variant die gebruikmaakt van het Cas9-eiwit. En de één werkt net iets anders dan de ander. In plaats van een rechte knip maakt een eiwit bijvoorbeeld een gehoekte knip in het DNA, waardoor het materiaal dat onderzoekers in het genoom willen plakken er als een puzzelstukje op past. Dat vergroot de kans dat het DNA met succes wordt herschreven.
Je kunt de verschillende CRISPR-Cas systemen vergelijken met gereedschap. De ene klus zal om een schroevendraaier vragen, terwijl je voor de andere juist een hamer nodig hebt. En het goede nieuws is dat de gereedschapskist steeds voller wordt: onderzoekers vinden in de natuur nog altijd nieuwe CRISPR-systemen. De hoop is dat deze nieuwe vondsten er uiteindelijk voor gaan zorgen dat wetenschappers het DNA in alle mogelijke cellen kunnen aanpassen.
Papierversnipperaar
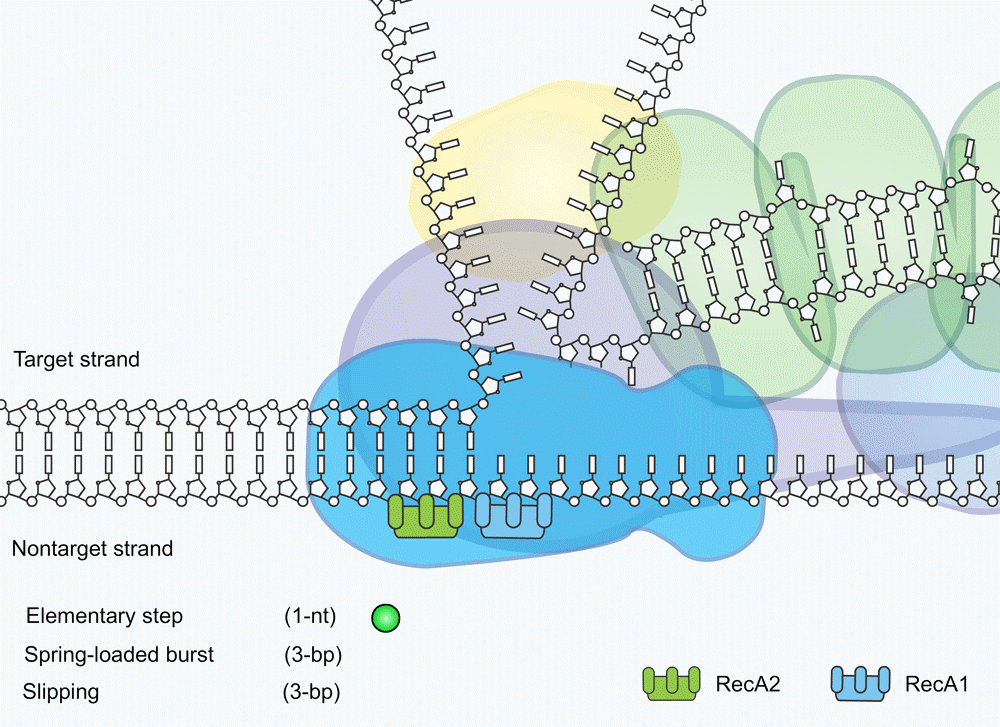
Dit specifieke onderzoek draaide om een relatief bekend en veelvoorkomend systeem: het zogeheten Cascade-complex. Dat is een eiwittenklomp die in de cytoplasma van de bacteriecel rondzweeft en daar DNA opspoort van virussen die proberen om de bacterie te infecteren. Op het moment dat het Cascade-complex virus-DNA tegenkomt, klampt het zich daaraan vast en geeft het een seintje aan het eiwit Cas3. Het Cascade-complex klapt dan open, waardoor Cas3 zich aan de eiwittenklomp kan vastgrijpen.
Vervolgens gaat het Cascadecomplex het virale DNA te lijf. Eerst ritst het zogenoemde helicase-domein van het Cascadecomplex het dubbelstrengs DNA uit elkaar. Vervolgens wordt het enkelstrengs DNA in het nuclease-domein, het Cas3-eiwit, geschoven. In het binnenste van het eiwit wordt het vijandige DNA dan aan flarden geknipt. “Je kunt Cas3 wel vergelijken met een biologische papierversnipperaar”, stelt onderzoeksleider Luuk Loeff.
Fluorescent
De belangrijkste vraag in dit onderzoek was: hoe gaat het Cas3-eiwit precies te werk? Er waren twee kampen. De meest populaire hypothese was dat het eiwit zich weer loskoppelt van het Cascadecomplex op het moment dat het DNA aangeboden krijgt. Vervolgens zou het eiwit volgens deze theorie over het DNA gaan ‘lopen’, waarbij het om de zoveel stapjes de DNA-streng zou doorknippen. Een andere, minder populaire theorie was dat Cas3 aan het Cascadecomplex blijft zitten en het DNA naar binnen trekt, als een visser die zijn lijn binnenhaalt.
Loeff en collega’s maakten bij hun onderzoek gebruik van zogeheten single-molecule-technieken, experimenten waarbij je de eigenschappen van een enkel molecuul bekijkt. Ze maakten DNA-moleculen fluorescent en observeerden op welke manier die fluorescentie tussen de moleculen werd overgedragen. “Fluorescente moleculen kun je zo gebruiken als een soort liniaal op de nanometerschaal”, legt Loeff uit. “Het stelt je in staat om afstanden te meten van tussen de één en tien nanometer, en dat is hoe groot eiwitten zoals Cas3 ongeveer zijn.”
Beschermingsmechanisme
De metingen van het Delftse onderzoek wijzen erop dat Cas3 blijft zitten waar het zit en het DNA in kleine stapjes naar binnen trekt: het zogenoemde reeling-mechanisme. Wat de onderzoekers daarbij opviel was dat Cas3 vrij inefficiënt te werk gaat. Terwijl het eiwit viraal DNA naar binnen trekt, laat het namelijk ook vaak los, waardoor de DNA-streng een klein stukje terugschiet. Soms laat het eiwit een DNA-streng zelfs helemaal glippen.
Loeff was in eerste instantie verbaasd over de inefficiëntie van Cas3. Maar er is een logische verklaring. “Een bacteriecel bevat veel eigen DNA, ook enkelstrengs, en als bacterie wil je niet dat Cas3 dat materiaal per ongeluk ook kapot maakt”, legt hij uit. “Door het DNA herhaaldelijk te laten glippen en dan weer naar binnen te trekken, zorgt de cel ervoor dat Cas3 op een gecontroleerde manier alleen vijandig DNA kapot knipt, en de cel dus niet onverhoopt zelfmoord pleegt. Het is een door de evolutie ontwikkeld beschermingsmechanisme.”
Het onderzoek van Loeff uit de groep van Chirlmin Joo, in samenwerking met Stan Brouns, draagt bij aan de kennis die we hebben over de werking van CRISPR-Cas-systemen. De hoop is dat deze kennis er in de toekomst voor zorgt dat onderzoekers deze biologische mechanismen beter naar hun hand kunnen zetten, en zo nog efficiëntere en veiligere manieren van gene editing kunnen ontwikkelen.
Meer informatie:
“Repetitive DNA reeling by the Cascade-Cas3 complex in nucleotide unwinding steps", Luuk Loeff, Stan J. J. Brouns, Chirlmin Joo, Molecular Cell
Contact
Luuk Loeff
+31 (0)15 27 82015
L.Loeff@tudelft.nl
Zie ook: onderzoeksverhaal ‘Sleutelen aan het Leven’ over Crispr-Cas9 (TU Delft)
